В настоящее время в Республике Беларусь одним из инструментов контроля за безопасностью и качеством медицинских изделий является государственная регистрация медицинских изделий (медицинской техники или изделий медицинского назначения) — система допуска к производству, реализации и медицинскому применению медицинских изделий, соответствующих установленным в нашей стране требованиям по безопасности, эффективности и качеству для человека:
- производимых на территории Республики Беларусь;
- поступающих из-за пределов Республики Беларусь.
Справочно: Государственная регистрация медицинских изделий осуществляется в порядке, установленном Положением о государственной регистрации (перерегистрации) изделий медицинского назначения и медицинской техники, утвержденным постановлением Совета Министров Республики Беларусь от 02.09.2008 № 1269 (по тексту — Положение № 1269).
Однако современные системы регулирования обращения медицинских изделий в экономически развитых странах основываются на принципах последовательного контроля безопасности, качества и эффективности на всех стадиях их жизненного цикла, а именно:
- разработки и допуска в обращение;
- использования в медицинской практике;
- в пострегистрационный период.
С целью сохранения и укрепления здоровья населения, обеспечения безопасности пациентов, медицинских работников и других пользователей, повышения качества оказания медицинской помощи, а также выявления и предотвращения серьезных и (или) непредвиденных побочных реакций, побочных явлений при применении, особенностей взаимодействия медицинских изделий между собой, фактов ненадлежащего качества при применении и эксплуатации медицинских изделий (далее, если не указано иное, — серьезные и (или) непредвиденные побочные реакции) Министерством здравоохранения в 2013 г. был введен мониторинг качества и безопасности медицинских изделий (далее — мониторинг).
Основными задачами мониторинга являются:
- недопущение попадания в аптечную сеть, организации здравоохранения, а также конечным пользователям медицинских изделий, которые не соответствуют требованиям безопасности, качества и эффективности;
- выявление и предотвращение любых побочных реакций, в т.ч. серьезных и (или) непредвиденных.
Основные мероприятия по выявлению серьезных и (или) непредвиденных побочных реакций
В организации здравоохранения должны быть приняты меры по выявлению серьезных и (или) непредвиденных побочных реакций.
В подавляющем числе организаций здравоохранения главная (старшая) медицинская сестра отвечает за оборот медицинских изделий. В связи с этим она должна хорошо знать примерный алгоритм действий при выявлении серьезных и (или) непредвиденных побочных реакций, а также обеспечить контроль за его выполнением подчиненными.
Примерный алгоритм действий при выявлении серьезных и (или) непредвиденных побочных реакций
Шаг 1. Приказом руководителя организации здравоохранения определяются:
- работник, уполномоченный на сбор и обработку информации о выявленных в организации здравоохранения серьезных и (или) непредвиденных побочных реакциях (далее — уполномоченный специалист);
- порядок передачи уполномоченному специалисту информации о выявленных в организации здравоохранения серьезных и (или) непредвиденных побочных реакциях.
Шаг 2. При поступлении в установленном порядке информации о серьезных и (или) непредвиденных побочных реакциях уполномоченный специалист заполняет приведенную ниже форму «Извещение о выявленных побочных реакциях, недостатках, неисправностях или несоответствиях применяемого медицинского изделия (медицинской техники или изделия медицинского назначения) установленным требованиям» (далее — извещение).
Форма
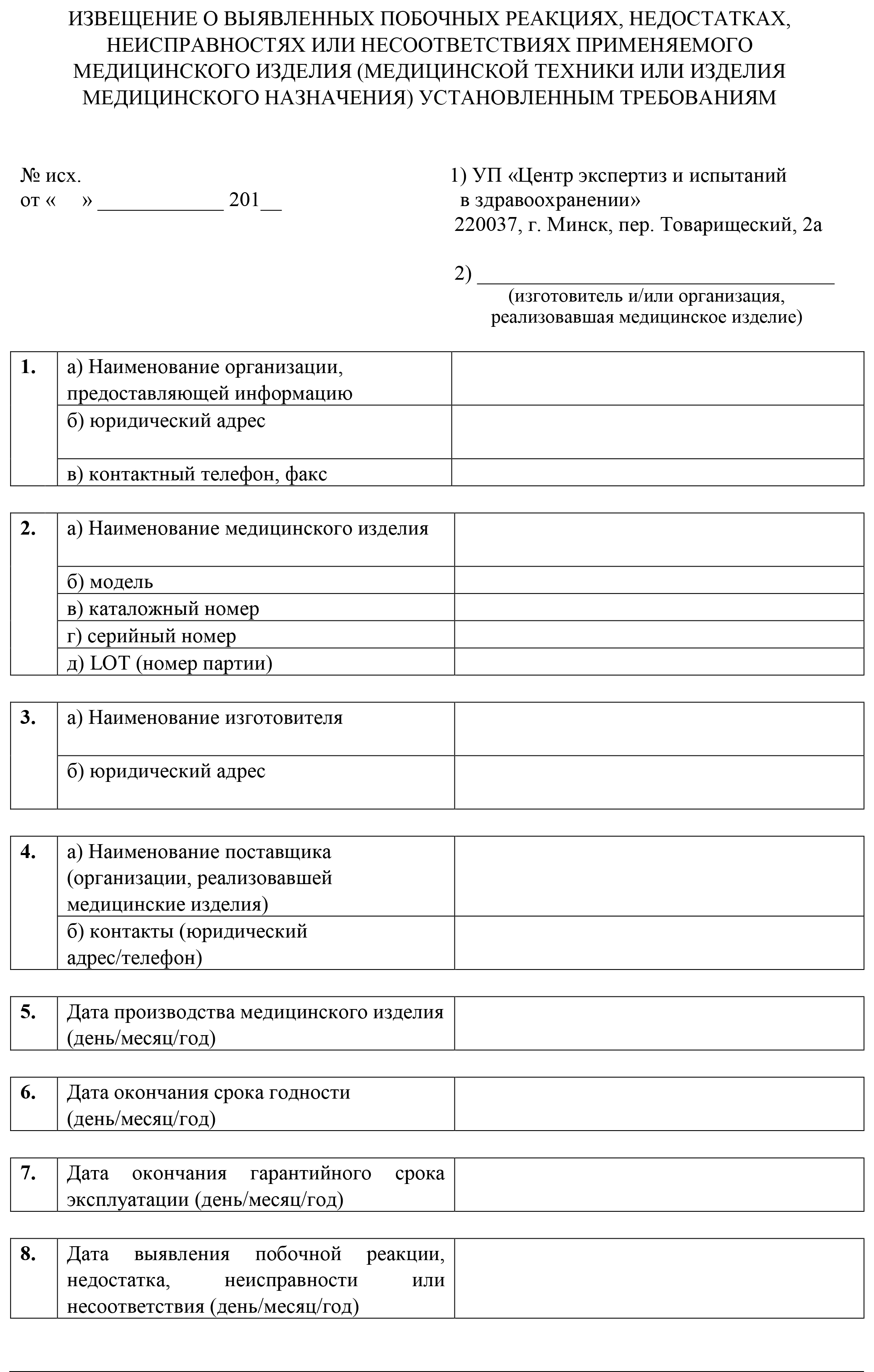

Извещение заполняется с соблюдением следующих требований:
1) информация вносится в виде печатного или рукописного текста на русском или белорусском языке;
2) заполняются все пункты без исключения;
3) сведения, указываемые в каждом пункте, должны быть полными и логически последовательными;
4) в строке «выявленные побочные реакции, недостатки, неисправности или несоответствия*» должно указываться полное и точное описание побочной реакции, недостатка, неисправности или несоответствия;
5) информация должна быть достоверной и подтверждаться соответствующими документами.
Справочно: Извещение можно скачать на сайте республиканского унитарного предприятия «Центр экспертиз и испытаний в здравоохранении» (по тексту — УП «ЦЭИЗ») («Безопасность» —> «Мониторинг качества медицинских изделий»).
Извещение подписывается исполнителем и руководителем организации здравоохранения с указанием фамилии и инициалов, а также проставлением гербовой (круглой) печати организации (при ее наличии). К извещению прилагаются копии документов, свидетельствующих или относящихся к факту выявления побочной реакции, недостатка, неисправности или несоответствия.
При несоблюдении какого-либо из вышеперечисленных требований извещение является недействительным.
Шаг 3. Уполномоченный специалист направляет извещение в УП «ЦЭИЗ» и организацию, реализовавшую медицинское изделие, не позднее 10 дней с момента выявления факта серьезных и (или) непредвиденных побочных реакций.
Основные мероприятия, проводимые УП «ЦЭИЗ» и Министерством здравоохранения
При проведении мониторинга УП «ЦЭИЗ» осуществляет следующие работы с целью выявления и предупреждения серьезных и (или) непредвиденных побочных реакций:
- сбор, регистрация и анализ полученных от организаций здравоохранения извещений;
- сбор, регистрация и анализ информации, касающейся безопасности качества и эффективности медицинских изделий, полученной от физических лиц, применявших медицинское изделие;
- сбор, регистрация и анализ информации, касающейся безопасности качества и эффективности медицинских изделий, полученной от субъектов обращения медицинских изделий, осуществляющих их производство, и (или) уполномоченных представителей производителя медицинских изделий;
- сбор, анализ и доведение до всех заинтересованных информации, касающейся безопасности качества и эффективности медицинских изделий, размещенной на сайтах иностранных организаций, уполномоченных на осуществление контроля за качеством и обращением медицинских изделий;
- предоставление Министерству здравоохранения информации по результатам мониторинга, в т.ч. по полученным извещениям.
Министерство здравоохранения в результате рассмотрения и анализа извещений может:
1) дать рекомендации изготовителям о необходимости:
- изменения технических нормативных правовых актов и эксплуатационной документации (инструкций по применению) на выпускаемые медицинские изделия;
- продления или уменьшения гарантийного срока на медицинские изделия;
2) принять согласно Положению № 1269 решение о приостановлении действия регистрационного удостоверения на медицинское изделие. Основанием для такого решения является следующее:
- в результате медицинского применения изделия медицинского назначения и медицинской техники возникла серьезная побочная реакция;
- установлен факт несоответствия качества изделия медицинского назначения или медицинской техники заявленному качеству при их государственной регистрации (перерегистрации) и (или) получены отрицательные результаты санитарно-гигиенических, технических и клинических испытаний;
- заявителем для государственной регистрации (перерегистрации) представлено регистрационное досье, содержащее недостоверные сведения, которые не были и не могли быть установлены при государственной регистрации (перерегистрации).
Собранная в рамках мониторинга актуальная информация размещается на сайте УП «ЦЭИЗ» («Безопасность» —> «Безопасность и качество медицинских изделий») и предназначается для специалистов системы здравоохранения, представителей фармацевтической промышленности и других заинтересованных лиц. Пример такой информации:

Проведение мониторинга качества и безопасности медицинских изделий является одним из важных путей повышения безопасности, эффективности и качества оказания медицинской помощи населению, улучшения и повышения качества жизни каждого человека.







